B)Glossaire
C)Protocole de l'extraction du dioxyde de titane à partir d'un minerai
A)Biblio/webographie
Un rapport danois sur la nucléation de nanoparticules d'or sur le dioxyde de Titane
Un dossier sur le nanomonde et les micropolluants anthropiques
Un dossier sur les nanotechnologies
Un article sur la photocatalyse
Un dossier technique sur les procédés chimiques de l'entreprises de ciment "Calcia"
Une classification canadienne des produits contenant du dioxyde de titane en ce qui a trait à leur cancérogénicité
Le projet PICADA (Photocatalytic Innovative Coverings Applications for Depollution Assessment)
Un page web proposant des représentations de la structure cristalline des composants du dioxyde de titane
Une thèse d'un futur docteur à l'école Polytechnique de Toulouse : Christos SARANTOPOULOS sur les photocatalyseurs à base de TiO2
Sur les effets du dioxyde de titane
Sur la minéralisation des polluants
Sur la photocatalyse
Un article sur la production et l'utilisation industrielle des particules nanostructurées
Une animation 3D et mobile des structures du dioxyde de titane
Un nanoforum concernant les matériaux de construction contenant du dioxyde de titane
Un rapport de l'Afsset (Agence française de sécurité sanitaire de l'environnement et du travail) sur les nanomatériaux
La nanotechnologie : L'innovation pour le monde de demain par la Commission Européenne
La Recherche (numéro 404, janvier 2007) "1 an de Science" : entretien avec Benoît Hervé-Bazin (p70)
Dossier de présentation 2009, Débat public : Développement et régulation des Nanotechnologies
Essential cell biology, second edition.traduit chez Medecine-Sciences, Flammarion 2e édition
Nanosciences, la Révolution invisible Christian Joachim, Laurence Plévert, Seuil (2004)
Bienvenue dans le nanomonde Ted Sargent, Dunod (2006)
B)Glossaire
- Clairance (pulmonaire), III :
- "paire électron-trou" : La lumière est capable d'apporter à un électron l'énergie suffisante pour qu'il quitte sa place. elle peut créer une paire électron-trou. Ainsi un semi-conducteur qu'on éclaire devient conducteur.
- La photocatalyse est le phénomène naturel dans lequel une substance, appelée photocatalyseur, accélère la vitesse d’une réaction chimique sous l’action de la lumière (naturelle ou artificielle).
- Echelle de Mohs, minéralogiste « allemand »
- aldéhyde
Elle est basée sur dix minéraux :
L'échelle de Mohs (1822), qui classe les minéraux selon leur dureté (résistance à la rayure). © L'Internaute
Les pierres précieuses ont, par exemple, une dureté supérieure à 7,5.
Protole de l'extraction du dioxyde de titane à partir d'un minerai
Matériel et produits
-Matériel pour montage à reflux (utilisant un ballon rodé monocol de 100 mL)
- Bechers de 50 mL, 100 mL
-Entonnoir à solide
-Eprouvettes de 10 mL, 25 mL, 50 mL, 100 mL (ou de préférence des dispensettes pour des raisons de sécurité)
-Capsule émaillée ou cristallisoir
-Büchner, filtres et fiole à vide
-Centrifugeuse et tubes
-Tubes à essai
-Pipette graduée de 1 mL
-Coupelle
-Balance au dixième de gramme
-Thermomètre
-Minerai reconstitué Solution d’acide sulfurique à 98 %
-Solution de thiocyanate de potassium de concentration molaire environ 10-2 mol.L-1
Mode opératoire
Première étape : Déshydratation de l’hydroxyde de titanyle, TiO(OH)2 afin d’obtenir l’oxyde de titane(IV), TiO2.
Travail sous la hotte, avec gants et lunettes.
-Peser 20 g de minerai dans un becher de 50 mL. Introduire, à l’aide de l’entonnoir à solide, les
20 g de minerai dans le ballon de 100 mL posé sur un valet.
20 g de minerai dans le ballon de 100 mL posé sur un valet.
-Préparer 2 mL d’eau mesurés à l’éprouvette graduée de 10 mL ; les introduire dans le ballon.
-Mesurer avec précautions 20 mL d’acide sulfurique ; les introduire lentement dans le ballon
Installer le réfrigérant. Régler le chauffage de manière à ce que le brouillard blanc, constitué de trioxyde de soufre et de sulfure d’hydrogène, monte doucement dans le réfrigérant et si possible ne s’échappe pas du montage. Maintenir le reflux (la réaction devient plus vive, le produit prend en masse) ; pendant 10 minutes.
Pendant ce temps, préparation de la seconde étape.
-Au bout des 10 minutes, dégager le ballon du chauffe-ballon (appeler éventuellement l’enseignant). Laisser refroidir en maintenant la circulation d’eau dans le réfrigérant pendant 5 minutes puis arrêter.
Seconde étape : Dissolution dans l’eau de sulfate de titanyle et élimination des parties insolubles.
-Mettre le ballon (toujours fixé au réfrigérant) dans une capsule émaillée ou un cristallisoir d’eau froide.
-Vérifier que la température de l’ensemble reste proche de 50 °C.
-Préparer 100 mL d’eau dans une éprouvette graduée de 100 mL.
-Ajouter lentement en agitant, avec un agitateur en verre, 100 mL d’eau. Avec l’agitateur en verre décoller la plus grande partie de la masse solide de la paroi du ballon afin de la dissoudre le mieux possible (les conditions expérimentales choisies ne permettent pas, en général, une attaque complète.
-Verser le contenu du ballon dans un becher.
Troisième étape : Elimination des parties insolubles par centrifugation puis hydrolyse des ions titanyles.
-Séparer le sulfate de fer (II) qui peut avoir précipité en partie, ainsi que la fraction de minerai non totalement attaquée, des ions titanyle, fer(II) et éventuellement fer(III) en solution, par centrifugation (en suivant les conseils de l’enseignant et en particulier en veillant à équilibrer les masses des tubes opposés). A la fin de la centrifugation, prendre les tubes délicatement dans la centrifugeuse.
Le filtrat (la solution noire) contient des ions titanyle, fer (II), fer (III) et sulfate. Les parties insolubles restent sur les parois et au fond du tube ; verser sans agiter et avec beaucoup de précaution le liquide noir dans un bêcher de 100 mL.
-Vérifier l’absence d’ions fer (III) dans le filtrat. Pour cela, prélever 0,5 mL de filtrat avec une pipette ; les introduire dans un tube à essai ; ajouter 1 mL d’eau et 1 goutte de solution de thiocyanate de potassium. Observer : un complexe rouge s’est-il formé ?
-Réaliser l’hydrolyse des ions titanyle
Si la présence d’ions fer(III) est constatée, traiter la solution avec une pointe de spatule de limaille de fer et filtrer immédiatement, aussitôt que la solution prend une teinte violette afin d’éliminer l’excès de fer.
_Puis, préparer à l’éprouvette graduée 40 mL de filtrat ; les introduire dans le ballon de
100 mL ;
100 mL ;
_Ajouter les 40 mL d’eau chaude (environ 50°C) dans le ballon.
_Réaliser le montage à reflux ; chauffer à reflux jusqu’au blanchiment du liquide, la teinte à obtenir est « chocolat clair » ; régler le thermostat en conséquence.
_Dégager le ballon du chauffe-ballon. Refroidir le ballon à l’air puis sous l’eau courante.
_Filtrer sur Büchner. Laver le précipité avec de l’eau distillée.
_Placer le précipité et le papier filtre dans une coupelle. Sécher à l’étuve.
Quatrième étape : Attaque à chaud du minerai par l’acide sulfurique ; formation de sulfate de titanyle et de sulfate de fer(II).
La calcination se fait entre 500 et 1000 °C. Utiliser une coupelle réfractaire et un bec à air chaud après séchage du produit.
Inspiré du protocole du site : http://www.edulyautey.org/~dtqd/Ressources/Textes/TP%20TS/Sp%E9cialit%E9/D2.doc
Définition réseau cristallin.
Un solide cristallin est constitué par la répétition périodique dans les 3 dimensions de l'espace d'un motif atomique ou moléculaire, appelé maille. La périodicité de la structure d'un cristal est donc représentée par un ensemble de points régulièrement disposés .C’est l’Abbé René Juste Haüy (1743-1822,), minéralogiste, qui découvra les sept systèmes cristallins : système cubique, quadratique, hexagonal, ternaire orthorhombique, monoclinique et triclinique.
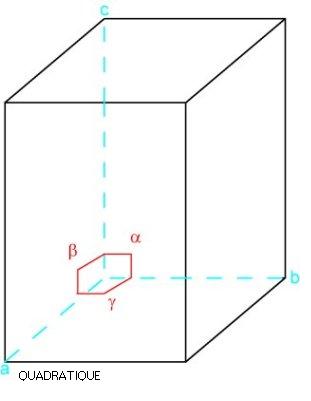
Système cristallin quadratique ou tétragonal :
Un système dont la maille élémentaire est un prisme à quatre côtés, où trois axes se coupent à angle droit. L'axe vertical est plus grand ou plus petit que les deux axes horizontaux qui, eux, sont d'égale valeur.
Exemple de système quadratique.
Système cristallin orthorhombique :
Comme dans les systèmes cubiques et quadratiques, trois axes se coupent à angle droit, mais tous ces axes ont des longueurs inégales et irrégulières.
Prisme quadratique
Prisme quadratique
Exemple de système orthorhombique.
Définition métastable.
Se dit d'un système qui n'est pas stable en théorie, mais qui paraît tel en raison d'une vitesse de transformation très faible.



Bonjour,
RépondreSupprimermerci pour ce blog intéressant.
Si j'ai bien compris, la photocatalyse au titane peut être dangereuse pour l'humain.
Que penser alors des pièges à moustiques qui utilsent ce procédé et dont les arguments sont le fait qu'ils attirent les moustiques grâce à cette photocatalyse qui, en détruisant bactéries et virus de l'air, produit du CO2 et donc attirent les moustiques et les piègent ?
Je ne peux pas remercier assez le service de financement léméridien et faire savoir aux gens à quel point je suis reconnaissant pour toute l'aide que vous et le personnel de votre équipe avez fournie et j'ai hâte de recommander des amis et de la famille s'ils ont besoin de conseils ou d'une assistance financière @ 1,9% Prêt commercial .Via Contact:. lfdsloans@lemeridianfds.com / lfdsloans@outlook.com. WhatsApp ... + 19893943740. Continuez votre excellent travail.
RépondreSupprimerMerci, Busarakham.